| 2 |
|
|
 |
|
|
| |
1.molecuulmassa
en molariteit
2.verdunningsreeksen
|
|
| |
Deel 1. Molecuulmassa
en molariteit
Leven wordt onder andere gekenmerkt door een groot en wisselend complex
van chemische reacties. Bij laboratoriumproeven met biologisch materiaal
worden dan ook allerlei chemicalien gebruikt. Deze zijn nodig voor het
mogelijk maken van bio-reacties onder laboratorium (lab)-omstandigheden
(soms ook voor het specifiek remmen van bepaalde reacties) en voor het
aantonen van de aanwezigheid van bepaalde stoffen.
Bio-reacties verlopen doorgaans optimaal binnen nauwe grenzen, en kleine
afwijkingen van de proefomstandigheden kunnen grote, meestal ongewenste,
gevolgen hebben voor het proefresultaat. Een ander punt is de enorme grote
aantal atomen betrokken bij chemische reacties. Het aantal atomen in 1g
stof is ongeveer 1022 tot 1023,wat groter is dan
het aantal zichtbare sterren. Om deze grote getallen uit te drukken, gebruikt
men de eenheid 'mol' om de hoeveelheid stof weer te geven.
Definitie mol: de hoeveelheid
substantie die evenveel objecten (atomen, moleculen, ionen enz)
bevat als het aantal atomen in precies 12 g 12C-atoom.
Dit aantal is : 6,02 ×1023
(aantal atomen in 12 g 12C)
Andersom kan zo ook de atomaire massaeenheid worden berekend: de
atomaire massaeenheid is per definitie 1/12 van de massa van een 12C-atoom.
Als symbool wordt me of
u gebruikt.
Er geldt: me=
1.66 ×10-27 kg
= 1.66 ×10-24 g(=1/6.02
×1023)
Een mol koolstof weegt dus = 12 gram.
(zie ook definitie mol)
De concentratie van oplossingen wordt uitgedrukt als molariteit
(mol·L-1 of M). het molecuulgewicht is hierbij weer
van belang. Molecuulgewichten (eigenlijk molecuulmassa's) van
macromoleculen worden vaak uitgedrukt in daltons, kilodaltons (eiwitten),
of megadaltons (DNA). Een dalton is hetzelfde als een atomaire massaeenheid.
Ook wordt de concentratie van oplossingen wel uitgedrukt in massa
concentratie met als eenheid g·L-1 of kg·L-1. Vaak wordt bij oplossingen een percentage gegeven, met als toevoeging bijvoorbeeld (w/v) (= weigth / volume). 1 % (w/v) betekent: 1 gram per 100 ml water.
|
|
| |
Hieronder staan een aantal vragen over de berekening van concentratie
en hoeveelheid benodigde stof. Een oplossing van 1 M bevat 1 mol opgeloste
stof in een eindvolume van 1L. Iets moeilijker is het om een oplossing
met een ander eindvolume en een andere molariteit te maken. Bv: 200
ml van een 0.15 M NaCl oplossing. Voor de berekening van de hoeveelheid
benodigde stof moet je de volgende punten afgaan:
|
|
| |
Bepaal eerst het molgewicht
(gewicht van 1 mol) van NaCl. Dit kan door de atoomgewichten bij elkaar op te tellen: NaCl = 23.0
+ 35.4 = 58.4 g·mol-1.
Vermenigvuldig het molgewicht met de gewenste molariteit:58.4
×0.15=8.8 g. Deze 8.8 g moet dus in een liter worden opgelost
om een 0.15 M oplossing te verkrijgen (=8.8 g·L-1).
Reken g/L nu om naar g/200ml (= gewenste volume)
door het aantal gram te vermenigvuldigen met het gewenste aantal liter
(let op eenheid: 200ml = 0.2 L). Dus 0.2 ×8.8 levert 1.8 g NaCl op.
Hieronder staan een aantal oefenvragen. Geef de antwoorden in 1 decimaal
nauwkeurig wanneer niet anders vermeld staat. Let hierbij op de afronding.
vb: 10.78 wordt afgerond naar 10.8 (gebruik de Angelsaksische decimaalnotatie met een punt,
dus geen 10,8). Omdat machten van 10 moeilijk te typen zijn, gebruiken
we hiervoor de volgende notatie: 4.7 10e-9 (= 4.7 · 10-9).
Let overal goed op de eenheden, bv 1.0 ml = 1.0 · 10-3
L
|
| |
VRAAG 1:
Hoeveel
gram NaCl (MW= 58) moet je afwegen om 20 ml van een 0.15 M zoutoplossing
te maken? Geef het antwoord in 2 decimalen
nauwkeurig.
VRAAG 2:
Hoeveel
gram NaCl (MW=58) moet je afwegen om 30 ml van een 0.35 M zoutoplossing
te maken? Geef het antwoord in 2 decimalen
nauwkeurig.
VRAAG
3:
Hoeveel
gram Tris (MW= 121 ) moet je afwegen om 75 ml van een 0.35
M oplossing te maken?
Geef het antwoord in 2 decimalen.
VRAAG
4:
Voor
een PCR reactie moet je een oplossing van een als poeder
geleverde DNA primer maken. De lengte van de primer is 20
nucleotiden, en het molecuulgewicht van een nucleotide is 325 Daltons.
Hoeveel microgram (10-6 g) moet je afwegen en oplossen
in 1 ml om een oplossing van 20 nM te verkrijgen? Geef
het antwoord in 2 decimalen nauwkeurig.
VRAAG
5:
In
de zuurkast staat een fles met 96% (w/w) H2SO4. Het etiket vermeldt verder
dat 1 l=1.84 kg en dat het molecuulgewicht van H2SO4 98.1 is. Wat
is de molariteit van deze H2SO4 oplossing?
VRAAG 6:
In de zuurkast
staat een fles met 87% (v/v) glycerol. Het etiket vermeldt verder dat
1 l = 1.23 kg en dat het molecuulgewicht van glycerol 92.1 is. Wat is
de molariteit van deze glyceroloplossing?
|
|
| |
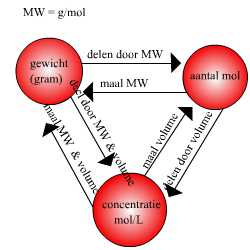
Figuur
2.1 omrekening van mol naar gram & mol/L enz.
|
|
| |
Deel 2. Verdunningsreeksen
Verdunningsreeksen worden bij veel procedures gebruikt: bijvoorbeeld
om een ijkreeks te maken voor een apparaat, of bij biologisch werk
waar veel wordt gewerkt met geconcentreerde voorraad-oplossingen (stock-oplossingen) zodat
niet steed opnieuw afgewogen hoeft te worden.
Er zijn meerdere aanpakken mogelijk
|
|
| |
Lineaire verdunningsreeks
Logaritmische verdunningreeks
Harmonische verdunningreeks |
| |
a. Lineaire verdunningreeks
Bij een lineaire verdunningsreeks worden de opeenvolgende concentraties
steeds verlaagd met hetzelfde getal, bv een serie die eiwitten bevat in
de volgende concentraties:
1.0, 0.8, 0.6, 0.4, 0.2, 0 µg·ml-1. Er kan gebruik
gemaakt worden van de volgende formule:
|
|
| |
[C1] × V1 = [C2] × V2
waarbij:
[C1] = concentratie voor de verdunning
[C2] = concentratie na de verdunning
V1 = volume voor de verdunning
V2 = volume na de verdunning
|
| |
b. Logaritmische verdunningreeks
Bij een logaritmische verdunningsreeks worden de concentraties steeds
verlaagd met een constante verhouding, vaak stap-interval genoemd. Dit
type verdunning is handig wanneer er een brede concentratiereeks nodig
is. Voorbeelden:
|
|
| |
dubbele verdunning, waar elke concentratie de helft is van de vorige(2-voudig
stapinterval). Maak van de hoogste concentratie 2× het volume dat
uiteindelijk nodig is. Doe de helft van
dit volume in een ander glas, voeg hetzelfde volume nogmaals
toe en schud goed. Herhaal dit een aantal keer totdat de verdunningsreeks is verkregen:
1/2, 1/4, 1/8, 1/16 enz.
decimale verdunning, waar elke verdunning 1/10de is van de vorige(10-voudig
stapinterval). Maak van de hoogste concentratie tenminste 10% te
veel. Neem hieruit 1/10 van het volume en voeg dit bij een glas met 9× dit volume
aanwezig, mix goed en herhaal dit een aantal keer.Uiteindelijk wordt de volgende verdunningreeks
verkregen: 1, 1/10, 1/100, 1/1000 enz. Zie figuur
2.2.
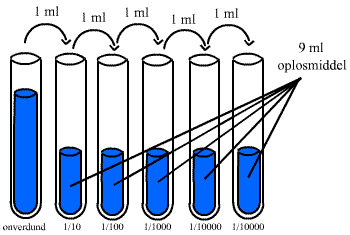
Figuur
2.2.Een verdunningsreeks
100 10-1
10-2 10-3 10-4
10-5
|
| |
c. Harmonische verdunningsreeks
Bij een harmonische verdunningsreeks worden de concentraties steeds
verlaagd met opeenvolgende hele getallen: 1, 1/2, 1/3, 1/4, 1/5 enz. De
individuele verdunningen worden eenvoudig verkregen door bij de oorspronkelijke
concentratie in aparte glazen steeds 0, 1, 2, 3, 4 en 5 keer het volume
van de oorspronkelijke concentratie toe te voegen.
Hieronder volgen een paar oefenvragen:
|
|
| |
|
VRAAG 7:
Hoeveel
delen 8 M NaCl moet je toevoegen aan één deel water om uit te komen
op een eindconcentratie van 2M NaCl? Schrijf het antwoord in de
vorm: 1/7.
VRAAG 8:
Hoeveel ml water moet je toevoegen aan 5 ml van
een 20 mM zoutoplossing om het 20 keer te verdunnen?
VRAAG 9:
Hoeveel ml water moet je toevoegen aan 4 ml
van een 50 mM zoutoplossing om het 25 keer te verdunnen?
en wat is dan de eindconcentratie?
VRAAG 10:
Je wilt 0.5 liter 10 mM Tris-HCl pH 7.5/ 1 mM EDTA maken om je geisoleerde
DNA in op te lossen. Je wilt dit maken mbv. een 1 M Tris-HCl pH
7.5 stock-oplossing en een pot vaste EDTA (MW: 372).
a) Hoeveel ml Tris stockoplossing moet je pipetteren
?
b) Hoeveel gram EDTA moet
je afwegen? Geef het antwoord op de volgende manier: 1.763
(dus drie cijfers achter de punt).
VRAAG 11:
Je wilt 0.25 liter 10 mM Tris/ 1 mM EDTA maken om je geïsoleerde
DNA in op te lossen. Je wilt dit maken mbv. een 0.2 M EDTA pH 7.5
stock-oplossing en een pot vaste Tris(MW: 121).
a) Hoeveel ml EDTA stockoplossing moet je pipetteren?
Geef het antwoord op de volgende manier: 7.89 (dus 2 cijfers achter
de punt).
b) Hoeveel gram TRIS moet je afwegen?
|
|
